
12 neue Arzneimittel für Krebserkrankungen führen vor 10 Arzneimitteln für immunologische Erkrankungen die Statistik der 43 neu in 2024 in Deutschland eingeführten Medikamente an. Das ist die Bilanz des Verbands der forschenden Pharmaunternehmen (vfa). Foto: ipopba/stock.adobe.com
Innovationsbilanz 2024: 43 Medikamente mit neuen Wirkstoffen – zwei Impfstoffe und zwei Reserveantibiotika
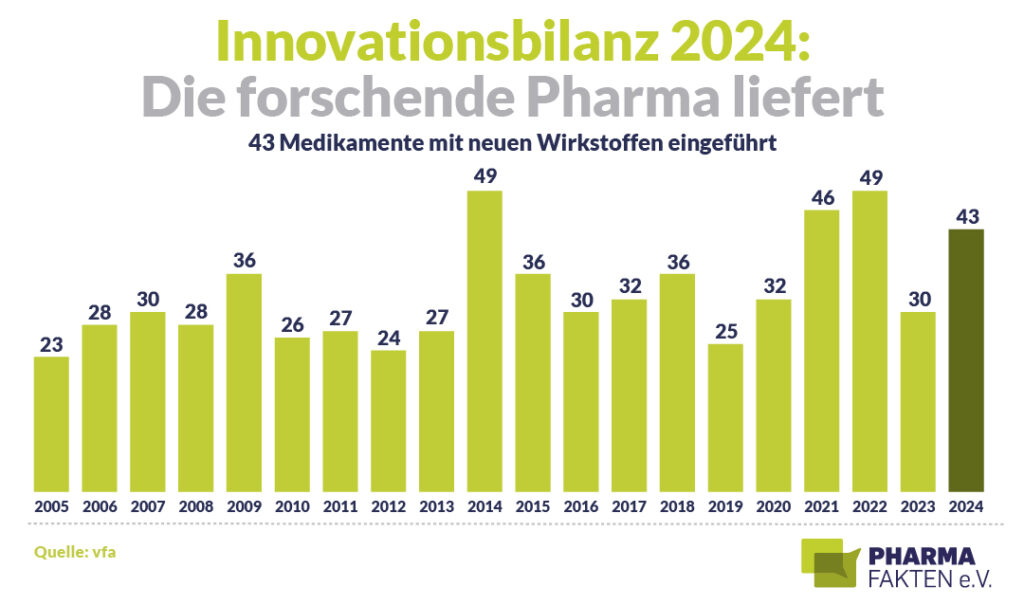
Der Verband der forschenden Pharmaunternehmen (vfa) zählt sie mit: Die Medikamente, die im Jahr 2024 in Deutschland neu eingeführt wurden, summieren sich auf 43. Hinzu kommen noch einmal 22 Zulassungserweiterungen. Nur dreimal gab es in den vergangenen 20 Jahren mehr Neueinführungen zu vermelden. Es ist ein Rekordjahr.
Mit 12 neuen Arzneimitteln führen Krebserkrankungen die Statistik an – der Innovationsschub zur Behandlung der Todesursache Nummer 2 geht unvermindert weiter. Dabei erweitert sich auch das Arsenal der personalisierten Therapien, etwa zur Behandlung von Speiseröhren-, Magen- oder Brustkrebs, bei Gallengangkarzinomen oder Leukämie. Voraussetzung für einen solchen Einsatz ist eine genetische Diagnostik, um den Treiber eines Tumors zu identifizieren. Neue, zielgerichtete Therapien setzen dort an, etwa indem sie bestimmte Rezeptoren blockieren und damit die Fesseln des Immunsystems lösen, um Krebszellen konsequent zu bekämpfen.
Die weiteren Innovationen verteilen sich laut vfa auf folgende Indikationen:
- Immunologische Erkrankungen: 10
- Infektionskrankheiten: 6
- Stoffwechselkrankheiten und Sonstige: je 3
- Neurologische Krankheiten (ohne Krebs und Autoimmunkrankheiten): 2
- Gynäkologische Krankheiten (ohne Krebs und Infektionskrankheiten): 2
- Herz-Kreislauf-Erkrankungen, Muskelerkrankungen, Knochenerkrankungen, Blutungskrankheiten, Bildgebende Verfahren: je 1.
- Darunter sind 2 neue Impfstoffe – gegen Tollwut und gegen das Atemwegsvirus RSV.
Neue Therapien für Menschen mit seltenen Erkrankungen
Seit Jahren schon belegt die Innovationsbilanz das Engagement der Industrie im Bereich der seltenen Erkrankungen, die laut EU-Definition bei nicht mehr als fünf von 10.000 EU-Bürgern auftreten dürfen, um als „Orphan Disease“ zu gelten. Das ist eine Voraussetzung für einen Orphan-Drug-Status, den es 2024 bei 18 neu eingeführten Arzneimitteln gab (Anteil: 42 Prozent). Insgesamt kamen aber sogar 27 Medikamente (63 Prozent) zur Behandlung seltener Erkrankungen heraus – sie haben nur nicht allesamt einen offiziellen Orphan-Drug-Status. Darunter sind: ein Pulver zur Herstellung einer Injektionslösung gegen schwere Malaria, gleich drei Arzneimittel zur Behandlung von Menschen mit paroxysmaler nächtlicher Hämoglobinurie (PNH, eine Krankheit, bei der das Immunsystem unter anderem rote Blutkörperchen angreift) oder eines zur Behandlung einer seltenen Lebererkrankung mit dem Namen Primäre biliäre Cholangitis.
Vfa-Präsident Han Steutel sagt: „Das zeigt das anhaltende Engagement der Branche dafür, dass auch Patientinnen und Patienten nicht unversorgt bleiben, deren Krankheit nicht häufig vorkommt.“ Die Einführung eines Orphan Drugs ist für die betroffenen Menschen in der Regel ein Meilenstein, weil bisher entweder gar keine ursächliche oder nur eine unzureichende Therapie zur Verfügung stand.
Zwei neue Reserveantibiotika
Einen kleinen, aber wichtigen Schritt vorwärts gibt es auch bei der Versorgung mit wirksamen Antibiotika zu melden; zwei neue Reserveantibiotika sind seit diesem Jahr verfügbar. Sie heißen so, weil sie dafür entwickelt wurden, „nur dann eingesetzt zu werden, wenn wirklich multiresistente Bakterien die Krankheitsursache sind“, wie es beim vfa heißt.
Seit Jahren wird deshalb diskutiert, wie ein Geschäftsmodell zur Entwicklung von Therapien gegen multiresistente Krankheitserreger aussehen könnte, weil sich mit Arzneimitteln, die für schlechtere Zeiten im Schrank zurückgehalten werden, die Entwicklungskosten nicht wieder einspielen lassen. Vfa-Chef Han Steutel merkt an: „Um auf Dauer mit der Verbreitung neuer Resistenzen Schritt zu halten, sind zwei neue Antibiotika pro Jahr nicht genug. Deshalb ist zu hoffen, dass sich die EU in ihrer Pharmagesetzgebung 2025 dazu entschließen kann, Anreize für die Entwicklung von mehr neuen Antibiotika zu setzen.“
Nur ein deutsches Labor an Wirkstoff-Entwicklung beteiligt
Weiter heißt es beim Verband: „Nur bei einem der 43 neuen Medikamente wurde der Wirkstoff unter Beteiligung deutscher Labors entwickelt – für ein Medikament gegen paroxysmale nächtliche Hämoglobinurie.“ Aber immerhin waren bei 31 Medikamenten (72 Prozent) deutsche Krankenhäuser oder Arztpraxen an der Erprobung im Rahmen klinischer Studien beteiligt.
„Doch mit dieser Quote sollte sich Deutschland künftig nicht zufriedengeben“, so Han Steutel. „Es sollte seine Attraktivität für klinische Studien wieder so steigern, dass Unternehmen bei möglichst vielen ihrer Medikamente hiesige medizinische Einrichtungen einbeziehen […]. Mit dem Medizinforschungsgesetz hat die Bundesregierung die Weichen dafür richtig gestellt; doch viel hängt davon ab, ob die nächste Regierung es auch vollständig umsetzt.“ Gerade für Menschen mit schweren Erkrankungen gilt, dass eine klinische Studie die letzte Therapieoption sein kann.
Und auch das ist Fortschritt, der bei Patienten ankommt: Gleich 22-mal wurden bereits vorhandene Medikamente gegen zusätzliche Krankheiten anwendbar gemacht, indem die Firmen nach einschlägigen klinischen Studien Zulassungserweiterungen erwirkt haben – vor allem bei Krebserkrankungen.
Mehr zum Thema: vfa-Innovationsbilanz 2024